Výzkum CLL
Výzkum molekul na povrchu buněk chronické lymfocytární leukémie přinesl překvapivá zjištění
Výzkumný tým složený z odborníků z CEITEC MU a Interní hematologické a onkologické kliniky FN Brno vedený Doc. MUDr. Markem Mrázem, PhD významně posunul dosavadní poznatky o vlivu moderní léčby na regulaci biologie chronické lymfocytární leukémie (CLL). Objev vědců z Ceitec MU a Fakutní nemocnice Brno publikoval časopis Blood.
Rozhovor s Doc. Markem Mrázem (FN Brno) o publikaci:
Co je chronická lymfocytární leukémie? Jak vzniká? Jaké mechanismy ji „spouští“?
Chronická lymfocytární leukémie je onemocnění, které vzniká z B lymfocytů, což jsou buňky, které za normálních okolností chrání tělo proti infekci tím, že produkují protilátky. Někdy se ale může stát, že dojde k maligní transformaci B lymfocytů a vznikne chronická lymfocytární leukémie nebo B buněčný lymfom. Chronická lymfocytární leukémie je nejčastější leukémií dospělé populace v Evropě. Je zajímavé, že ke vzniku tohoto nádoru často přispívá porušení molekulární dráhy, která má právě na starosti produkci protilátek (tzv. BCR signalizace).
„Porušení molekulární dráhy“… to je pro laika hodně abstraktní. Co si pod tím máme představit a proč k tomuto porušení dráhy dochází?
U této leukémie dochází k „permanentní“ aktivaci BCR signalizační dráhy, která ale má být aktivní jen při infekci. Právě mechanismy aktivace této dráhy studujeme v naší laboratoři. V zásadě zatím není jasné, jak k němu dochází, neboť u této leukémie se nevyskytují mutace v genech pro proteiny řídící tuto dráhu (takové mutace se vyskytují u B lymfomů). Dalo by se říci, že i pro vědce a lékaře je vznik této choroby taková „enigma“ hematologie.
Jak probíhá základní léčba chronické lymfocytární leukémie?
Základní léčba tohoto onemocnění je založena většinou na kombinaci chemoterapie a tzv. monoklonálních protilátek. Chemoterapie poškozuje především maligní buňky a způsobuje jejich přímou smrt. Monoklonální protilátky jsou většinou cílené proti povrchovým molekulám označovaným jako CD20 na nádorových buňkách a tak je lépe „zviditelní“ pro imunitní systém, který je pak snáze rozpoznává a likviduje. Kombinace těchto přístupů může být velice účinná, ale ne všichni pacienti na takovou terapii odpovídají a také je relativně náročná pro pacienta. Nejnovější léky využívají cílené inhibice BCR signalizace, což je velmi účinné, ale stále to nevede k vyléčení pacientů a tato choroba zůstává nevyléčitelnou (kromě transplantace hematopoetických kmenových buněk). V poslední době se předpokládalo, že kombinace BCR inhibitorů a monoklonálních protilátek proti CD20 by mohla být nejlepší terapeutickou cestou.
Prestižní světový časopis pro onkologii Blood nedávno publikoval vaši práci zabývající se právě kombinací BCR inhibitorů a protilátek proti CD20. V čem spočívá Váš objev?
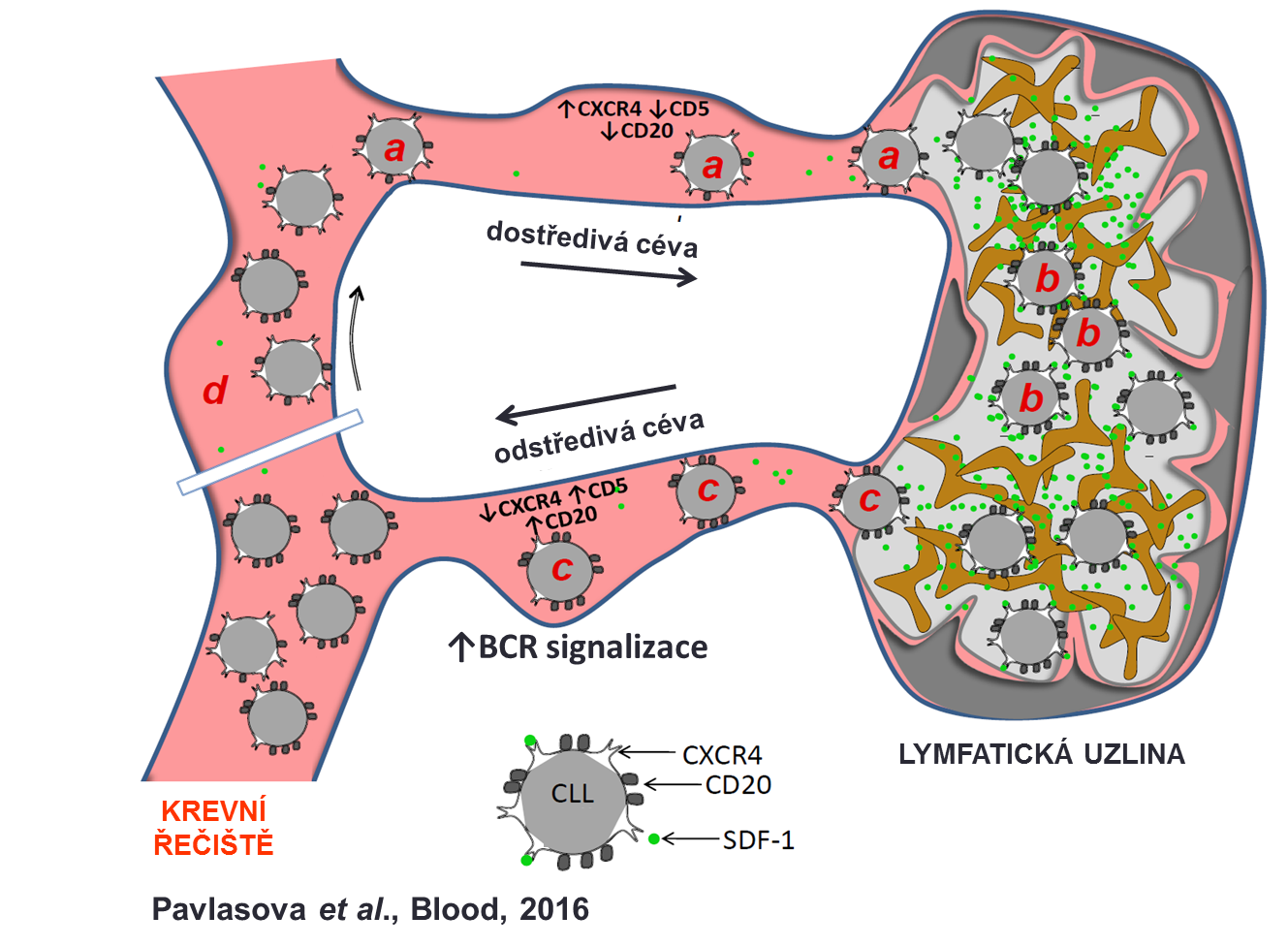
Zajímalo nás, co reguluje hladiny CD20 na povrchu leukemických buněk, protože přesto, že na tuto molekulu terapeuticky cílíme protilátkami již více než 15 let, tak stále není prakticky vůbec známo, jaká je její funkce a jak je regulována. Popsali jsme přesný mechanismus toho, jak je řízena její hladina a také jaké by to mohlo mít funkční důsledky. Při této příležitosti jsme analyzovali také několik vzorků od pacientů, kteří dostávali moderní BCR inhibitory a všimli jsme si, že jejich aplikace vede k prudkému snížení hladin CD20 na leukemických buňkách. Vysvětlili jsme přesný mechanismus tohoto jevu, který souvisí s regulací hladin CD20 v mikroprostředí lymfatických uzlin pomocí chemokinu SDF1 a jeho receptoru CXCR4 (viz obrázek), což právě ibrutinib blokuje a tím sníží hladiny CD20. Aplikace ibrutinibu vede vlastně ke ztrátě molekuly, kterou chceme potenciálně využít k zviditelnění buněk pro imunitní systém. Zároveň jsme ale našli i několik jiných molekul, které se chovají opačně a mohly by být dobrými kandidáty pro cílenou léčbu v kombinaci s BCR inhibitory. Ty budeme dále testovat v laboratoři.
Jaký bude dopad těchto vědeckých poznatků do klinické praxe? Změní se tím okamžitě léčba CLL pacientů?
Naše publikace není klinickou studií, takže nemůže mít přímý vliv na to, jak jsou pacienti s CLL léčeni. Naše práce a další publikace částečně vysvětlují, proč existují určité „biologické zábrany“ v kombinaci jednoho z nových léků používaných v léčbě chronické lymfocytární leukemie ibrutinib s protilátkou rituximab. V našem pokračujícím výzkumu se snažíme na molekulární úrovni pochopit, jak by bylo možné kombinovat ibrutinib a další BCR inhibitory s jinými léčivy a pak tyto kombinace testovat v laboratoři na buněčných modelových systémech. Z laboratoře je ale zatím stále relativně velmi dlouhá cesta k případné klinické studii.
Co pro Vás osobně znamená to, že Vaši práci publikoval prestižní americký časopis Blood?
Je velmi potěšující, že výzkum vedl k publikaci v časopise, který čte většina hematologů na světě a také to, že je výsledkem spolupráce CEITEC MU s Fakultní nemocnicí Brno a několika špičkovými nemocnicemi v USA (Harvard, Univerzita v Kalifornii). Doufáme, že to povede k ještě produktivnější spolupráci v budoucnu.
Jak Vy osobně vidíte budoucnost léčby chronické lymfocytární leukémie a dalších malignit?
Věřím, že v relativně blízké budoucnosti se podaří najít vhodný lék(y) do kombinace s BCR inhibitory. Tím snad alespoň u části pacientů bude možné chorobu lépe kontrolovat. Dovolím si odhadnout, že tyto poznatky o biologii a léčbě chronické lymfocytární leukémie pak povedou také k výraznému zlepšení v terapii u tzv. B buněčných lymfomů, což jsou biologicky velmi podobné choroby.
Rozhovor s doc. MUDr. Markem Mrázem, Ph.D., FN Brno
(Pavel Žára, tiskový mluvčí FN Brno a Jana Pelouchová za pacienty spolku Diagnóza leukemie)